양자수에 대해서 알아보겠습니다.

양자수란
양자수는 원자 내 전자의 위치와 에너지(양자계)를 설명하는 데 사용되는 숫자의 집합(set of numbers)입니다. 대게 정수(integer)거나 반정수(±1/2)입니다. 원자 내 전자의 상태는 4가지 양자수(n, l, ml, ms)에 의해 결정됩니다.
- 양자역학에서 관찰되고 보존되는 물리량들이 양자화되어 이산적인 값을 가짐
- 양자화된 각각의 상태는 파동함수로 기술되며 파동함수(wafe function)는 슈뢰딩거 방정식의 해로 얻어짐
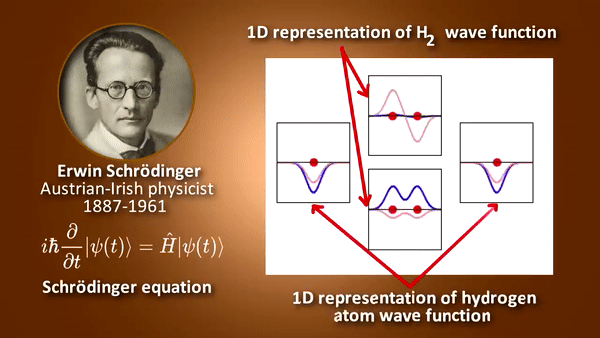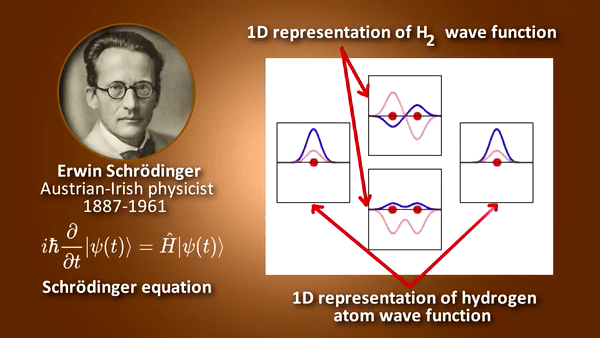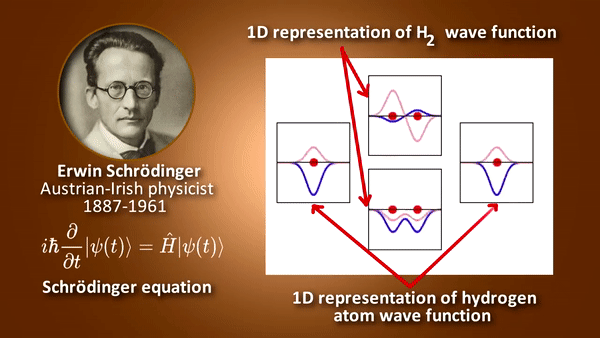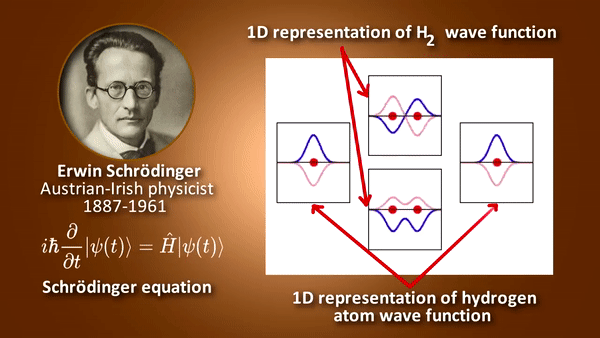

- 원자 안에서 전자의 에너지 등을 묘사하며 그 외에 각운동량이나 스핀 등에 대한 정보를 가짐
양자수 영어로
양자수는 영어로 Quantum Number입니다.
양자수 4가지
전자를 설명할 수 있는 양자수에는 총 4가지가 있습니다.
- 주 양자수(principal quantum number)
- 방위 양자수(azimuthal quantum number / orbital angular momentum quantum number)
- 자기 양자수(magnetic quantum number)
- 자기 스핀 양자수(magnetic spin quantum number)

양자수 4가지 요약
다음과 같이 요약할 수 있습니다.


주 양자수(principal quantum number)
- 주 양자수(n)는 원자의 오비탈 또는 원자가 가지는 에너지 준위를 나타냅니다. (electron levels of an atom)

- n이 1이면 이는 전자의 가장 낮은 에너지 상태에 해당하며 원자와 가장 가까운 안쪽 전자 껍질(innermost electron shell)을 나타냅니다.

- 전자에 에너지가 주입(infused with energy, "excited state")되면 전자는 더 높은 에너지 상태의 전자 껍질(outer shell)로 점프하고 n값 또한 증가합니다.
- 반대로 전자가 에너지를 잃으면(energy emission as light) 더 낮은 껍질(inner shell)로 이동하고 n값 또한 감소합니다.
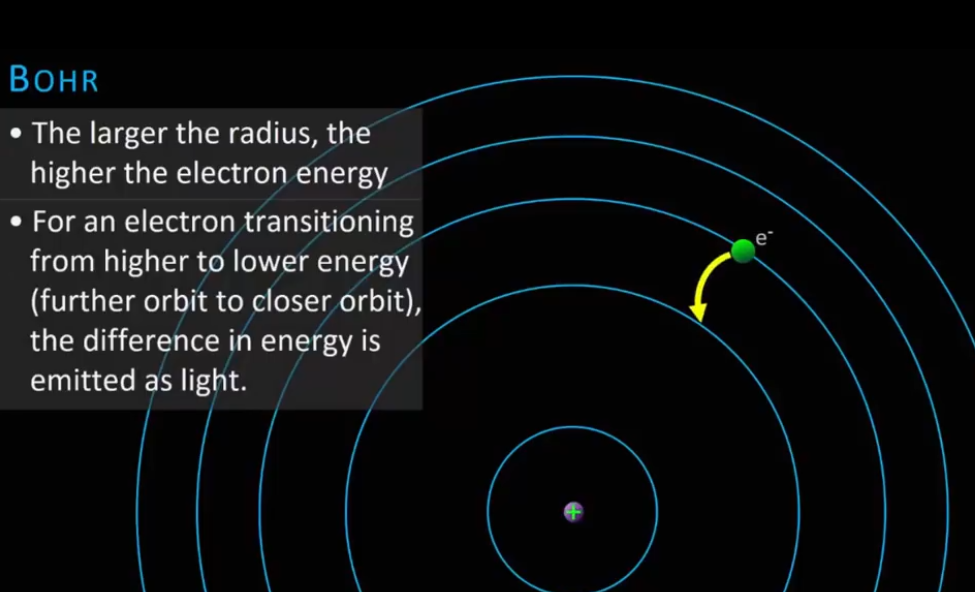

물리적 특징
- 공전 궤도 반경(궤도 반경 크기)
- 주 양자수 n은 보어 모델 식에서의 n을 말함
양자화 특징
- 에너지의 양자화(궤도함수 에너지 크기)
- 궤도함수 에너지 크기는 부양자수 l값에도 일부분 의존함
- 하지만 주로 주 양자수 n값에 의존
방위 양자수(azimuthal quantum number)
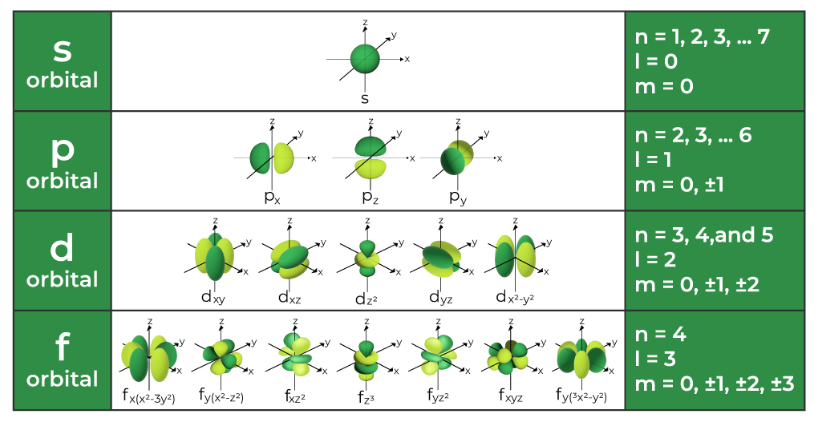
- 방위 양자수(l)은 각 양자수 또는 궤도 양자수라고 알려져 있으며 오비탈의 각운동량을 결정합니다.(shape of electron cloud)
- 방위 양자수의 값은 s, p, d, f 오비탈 모양을 알려줍니다.
방위 양자수와 오비탈 모양

물리적 특징
- 전자 구름의 일반적 모양 (궤도 함수의 모양)
양자화 특징
- 각 운동량의 양자화
자기 양자수(magnetic quantum number)
- 자기 양자수(ml)는 전자 구름이 좌표계에서 어떤 방향으로 위치해 있는지 알려주는 양자수입니다.(orientation of the electron cloud)
물리적 특징
- 궤도면의 방향/기울기 (궤도면 배향)
양자화 특징
- 공간 양자화(궤도함수 방향의 양자화)
자기 스핀 양자수(magnetic spin quantum number)
- 자기 스핀 양자수(ms)는 주어진 입자의 각 운동량을 나타내는 양자수입니다.(spin of electron)
- ms이 가질 수 있는 스핀상태는+1/2와 -1/2로 두 가지 상태입니다.

스핀 양자수가 상기 3가지 양자수(n, l, ml)와 다른 점
- 위 3가지 양자수는 원자 내 궤도함수의 크기(에너지), 모양, 방향을 나타냄
- 스핀 양자수는 전하의 종류(+, -)처럼 전자 고유의 성질을 나타냄
- 2개 이상의 전자가 존재할 때만 의미 있음
양자수와 오비탈의 예
각기 다른 양자수의 조합(n, l, ml)이 보여주는 오비탈의 예를 다음과 같이 보여줍니다.
정보 인용웹사이트
https://www.youtube.com/watch?v=tq_y1qOmUBE&t=575s
https://www.youtube.com/watch?v=accyCUzasa0
https://www.youtube.com/watch?v=fP2TAw7NnVU&t=746s
https://www.youtube.com/watch?v=Aoi4j8es4gQ&t=462s
https://www.youtube.com/watch?v=oLd-6UytkIU
https://www.youtube.com/watch?v=kpa_HO6yy18
https://www.youtube.com/watch?v=mc979OhitAg&t=540s
https://www.chemistrylearner.com/quantum-numbers.html
https://www.geeksforgeeks.org/quantum-numbers/
http://www.ktword.co.kr/test/view/view.php?m_temp1=4464
'과학' 카테고리의 다른 글
| 일, 에너지, 일률 | 정의, 단위, 특징, 에너지 종류(운동, 위치, 스프링) (0) | 2023.09.04 |
|---|---|
| 전하 | 전자기장, 만유인력의 법칙과 쿨롱의 법칙, 아원자 입자, 기본 전하, 1 암페어, 전하 밀도 (0) | 2023.09.01 |
| 원자가 전자 | 특징, 예(탄소 구리 붕소), 최외각 전자와 차이, 개수(주기율포의 족과 전자 배치에 따라 결정) (1) | 2023.08.30 |
| 약리작용 | 의미, 분류(흥분, 억제, 직접, 간접, 전신, 국소, 선택, 일반, 주작용, 부작용, 유해작용) (0) | 2023.05.09 |
| 탄소 이온 | 탄소의 특징 및 구조, 탄소 동위원소, 탄소 이온의 의학적 활용(Carbon Ion Radiotherapy) (0) | 2023.04.27 |




댓글