미국 FDA의 혁신적 의료기기 프로그램에 대해서 알아보겠습니다.

혁신적 의료기기 프로그램(Breakthrough Devices Program)이란
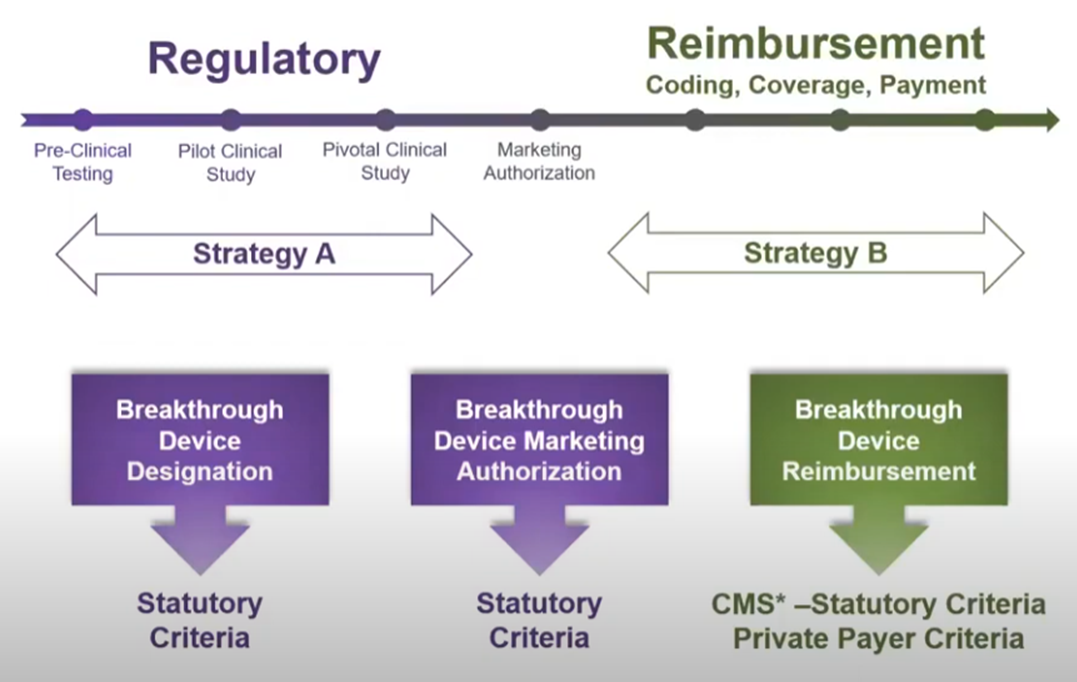
개발 중인 의료기기가 임상시험을 통과하고 미국 FDA의 인허가를 받은 후에 시판하는 과정은 많은 비용과 시간을 필요로 해서 다양한 질환을 진단 및 치료할 수 있는 의료기기의 발전을 지연시키는 하나의 요인으로 인식되었습니다. 이러한 개발 허들의 난이도를 낮추어서 대중들이 더 빨리 다양한 질환에 대해서 혁신 의료기기의 혜택을 누릴 수 있게 만들어진 것이 미국 FDA의 혁신적 의료기기 프로그램입니다.

의료기기 제조사가 판단하였을 때 자사가 개발하는 의료기기가 이에 해당하면 지원할 수 있는 프로그램(volutanry program)입니다. 기존의 신속 승인 인허가 과정을 대체합니다.

혁신 의료기기 프로그램이 생겼다고 해서 PMA(premarket approval), 510(k) clearance, De Novo 등 기존의 미국 FDA 인허가 스탠다드가 바뀌는 것은 아닙니다.


혁신적 의료기기 프로그램은 2018년부터 시작되었습니다. 기존의 신속 승인 인허가 과정(Expediated Access Pathway)는 2018년 이후로는 진행하지 않습니다.
혁신적 의료기기 프로그램이 제공하는 혜택
혁신 의료기기로 지정된 의료기기는 다음과 같은 혜택을 누릴 수 있습니다.
- FDA 승인 절차의 우선순위를 확보(FDA prioritizes 510k and De Novo submissions for breakthrough devices over other 510k and De Novo submissions, and the FDA’s senior management is involved in the review process.)
- 향후 승인 과정에서 FDA와 빠르고 원활한 의사소통을 진행할 수 있음
- 더 유연한 임상연구 설계, 전문 심사팀 배치 등 FDA의 추가 지원을 받음
- 미국 기준, CMS(Centers for Medicare and Medicaid Services)를 통해 보험급여(reimbursement)를 제공할 수 있습니다. 기존 의료 신기술은 CMS를 통해 보험급여 제공 자격을 얻기까지 2년 이라는 기간을 기다려야 했습니다.
혁신적 의료기기 프로그램 지원 자격
개발하는 의료기기가 혁신적 의료기기 프로그램 기준에 포함되어서 제품 개발에 도움을 받으려면 회사가 개발하는 의료기기가 다음의 기준을 충족시켜야 합니다.

우선 의료기기의 진단 및 치료대상이 생명을 위협하는 질환(life-threatening disease)일 경우나 회복할 수 없는 기능소실 질환이나 상태(irreversibly debilitating diseases or conditions)일 경우에 해당합니다.
다음로 다음 4가지 기준 중 하나(at lease one)에 속하는 경우입니다.
- 혁신적인 기술을 의료기기로 구현함
- 대체 치료법이 없는 질환 상태를 치료하는 의료기기
- 기존 치료와 비교하여 의미있는 장점이 있음
- 환자 관점에서 최선의 이익에 부합할 경우
혁신적 의료기기 프로그램 지원 시기
명확한 지원시기가 요구되는 것은 아니지만 FDA에 Premarket Submission(PMA, 510(k), De Novo)을 보내기 전에 해야 합니다.

혁신적 의료기기 프로그램 지원 방법
Q-submission을 통해서만 지원한 후 혁신 의료기기로 지정될 수 있습니다.

혁신적 의료기기 프로그램 지원시 기재해야 하는 내용
다음과 같은 내용들이 포함됩니다.

- 의료기기에 대한 설명
- 목표로 하는 적응증
- 인허가 히스토리
- 혁신적 의료기기 프로그램 자격에 대한 지원사의 설명
- PMA, 510(k), De Novo 등 FDA Premarket Submission 정보
혁신적 의료기기 프로그램 승인 소요 시간
회사가 프로그램에 지원한 후 60일(calendar days) 정도에 승인 가부 여부가 결정됩니다.
프로그램에 지원한 후 30일 내에 FDA가 추가 정보를 요구할 수 있습니다.

혁신적 의료기기 프로그램 최신 트렌드
2023년 3월 31일 기준으로 794개의 의료기기가 혁신 의료기기로 선정되었습니다.

아래의 표에서는 매년 혁신 의료기기로 선정되는 의료기기의 수를 알려줍니다.

아래의 표에서는 임상 패널별로 혁신 의료기기로 지정된 의료기기의 수를 보여줍니다.

혁신 의료기기로 지정된 의료기기들을 임상 패널에 떄라 분류해보면 심혈관계(cardio) 질병을 치료하기 위한 의료기기의 수가 173계로 가장 많으며 그 뒤로 신경계(neuro), 정형외과(ortho), 소화기내과(gastro) 및 비뇨기과(uro) 순으로 이어졌습니다.
심혈관계와 신경계 질환 치료 의료기기가 생명을 위협하는 질환(life-threatening disease) 대상인 경우가 많아서 혁신 의료기기에 선정된 비율이 높은 것으로 판단됩니다.

혁신 의료기기로 지정된 후 모든 인허가 절차를 마무리(made it through all the way to a clearance) 한 경우는 전체 794건 중 67건이 해당 되는 것으로 확인됩니다.

혁신 의료기기로 지정이 되었다고 해도 모든 인허가 절차가 100% 성공적으로 마무리 되거나 빨리 진행된다는 것을 보장하지 못한다는 인사이트입니다.
기존 의료기기의 효과 및 안정성을 개선한 경우도 있었고 디지털 치료제(DTx)와 인공지능(AI)이 결합된 의료기기 등 새로운 형태의 의료기기도 다수 포함되었습니다. 혁신 의료기기로 지정된 소프트웨어 중 58%가 AI를 이용한 제품이고 8%는 DTx였습니다.
정보 인용웹사이트
https://www.fda.gov/medical-devices/how-study-and-market-your-device/breakthrough-devices-program
https://www.youtube.com/watch?v=cBYonVA1ikU
https://www.youtube.com/watch?v=6h0YWSEMqn8
https://www.youtube.com/watch?v=OO-fu6-ZY44
https://medicaldeviceacademy.com/breakthrough-device-designation/
https://www.nsmedicaldevices.com/analysis/october-fda-breakthrough-device-designations/
http://m.healthfocus.co.kr/news/articleView.html?idxno=108989


댓글